
近日,浙江大学医学院附属第二医院眼科中心姚克教授团队在国际权威期刊Clinical and Translational Medicine (IF: 11.493)在线发表了题为“Screening based identification of xanthone as a novel NLRP3 inflammasome inhibitor via metabolic reprogramming”的一项研究。该研究基于筛选发现了一种新的小分子天然化合物xanthone作为NLRP3炎症小体活化的抑制剂,有望用于治疗角膜炎[1]。
角膜炎是一种眼表炎症性疾病,其特征是炎性细胞的浸润和角膜结构的破坏。疾病的早期治疗对于良好的预后至关重要,如不及时治疗可能导致角膜穿孔、瘢痕形成和永久性视力丧失等严重的后遗症[2]。感染性角膜炎至今仍是世界性的常见致盲眼病,其中细菌和病毒是感染性角膜炎的常见诱导因素。尽管抗生素和抗病毒药物能够消除微生物,继发于感染的角膜炎症过程却并不会立即停止,造成持久和反复的角膜组织破坏。目前,临床上多使用抗炎药物或免疫抑制剂来治疗角膜炎,但这些药物的选择有限,且会产生较严重的副作用,包括白内障、青光眼和角膜愈合延迟等。因此寻找有效而安全的角膜炎新型治疗手段显得尤为重要。
NLRP3炎症小体是一类监测细胞内稳态的大分子聚合物,能够感知病原、环境和内源应激等刺激,参与炎症反应。据报道,异常的NLRP3炎症小体活化参与到角膜炎性疾病的发生与发展中[3]。在本研究中,作者利用40多种小分子天然产物处理原代巨噬细胞,筛选得到xanthone能够剂量依赖地抑制NLRP3炎症小体第二信号的激活,而不影响第一信号。在人外周血中,xanthone也能显著抑制单个核细胞的IL-1β产生。
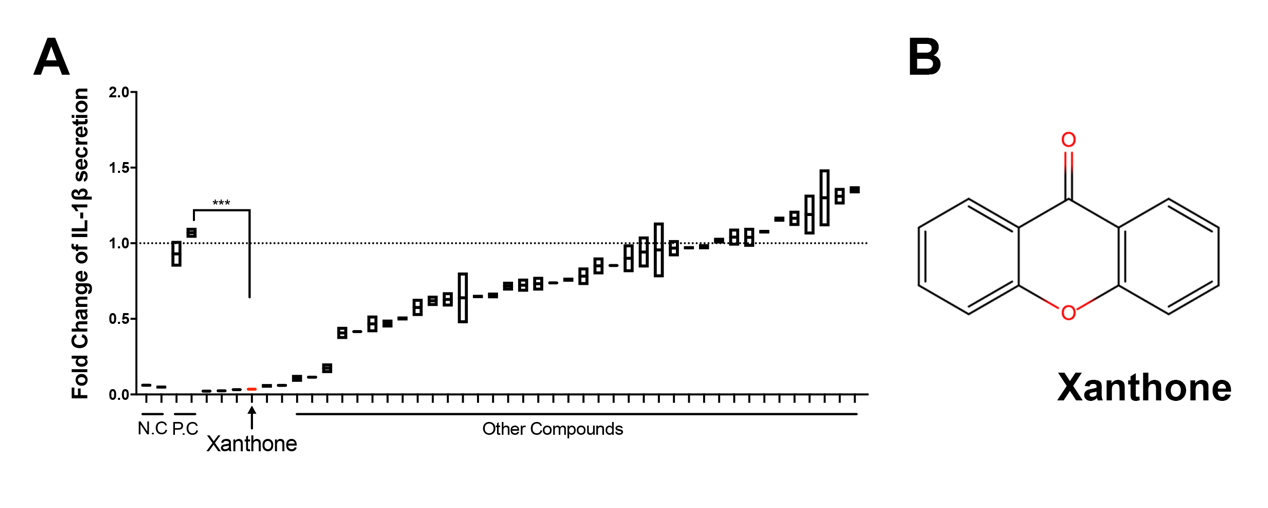
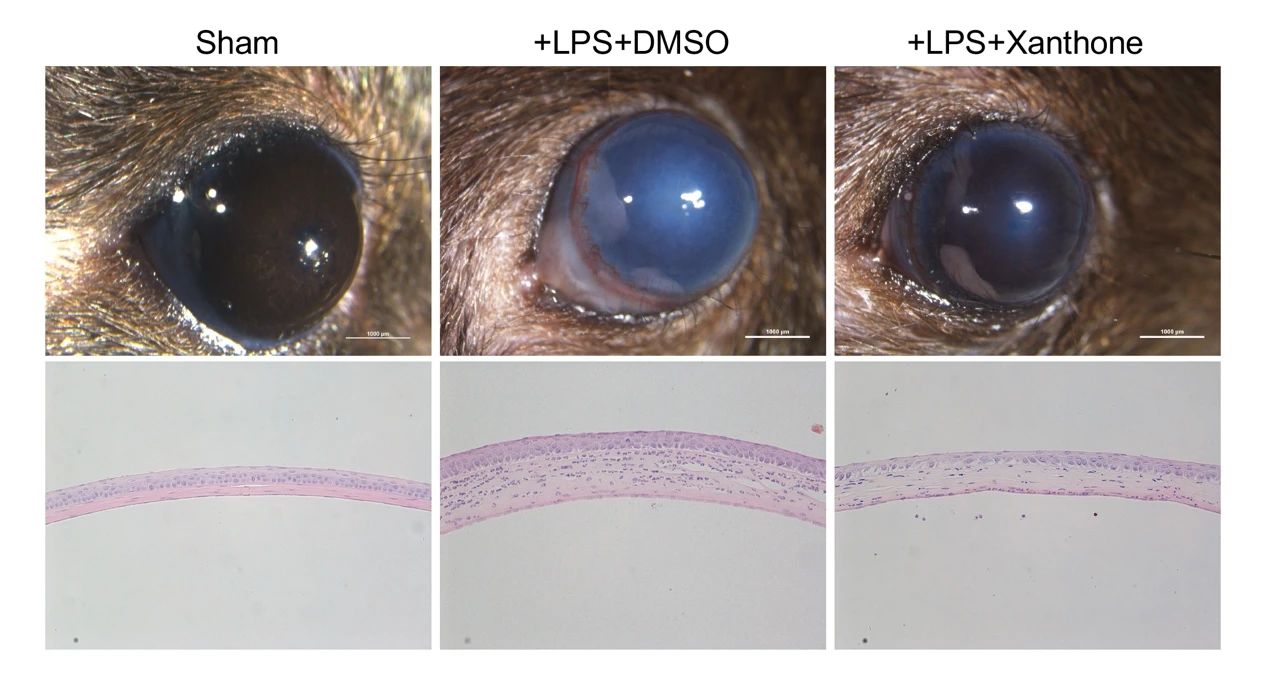
作者利用小鼠角膜基质内注射脂多糖诱导角膜炎症模型,发现xanthone滴眼能够显著降低角膜浑浊度,提高角膜临床评分。组织切片显示xanthone治疗减少了角膜中炎性细胞的浸润,降低了炎症导致的角膜厚度增加。进一步地,作者发现xanthone能够抑制角膜组织中LPS诱导的IL-1β分泌和组织浸润巨噬细胞中NLRP3炎症小体的激活。生物相容性实验证明xanthone不影响角膜上皮细胞的生物活性。
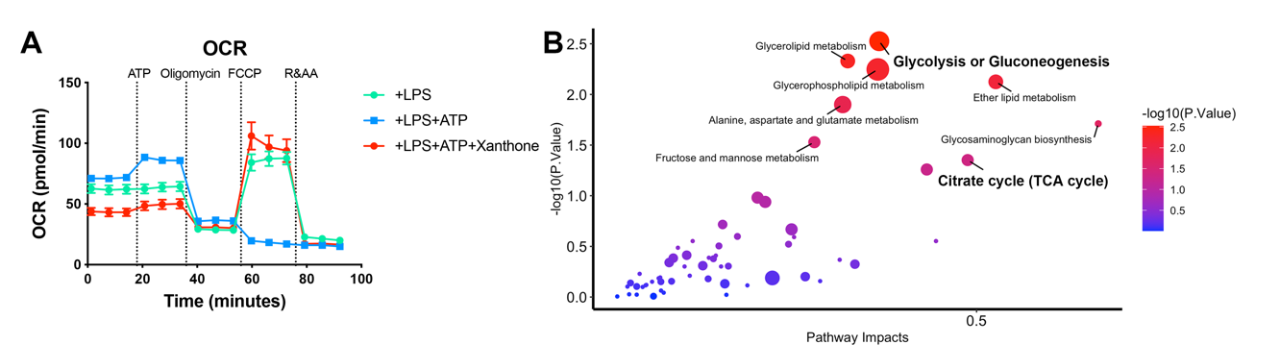
线粒体功能障碍和钾离子外流是NLRP3炎症小体活化的两个主要发生机制。作者证明xanthone特异性抑制线粒体损伤,而非钾离子外流介导的NLRP3激活。Xanthone能够挽救ATP(NLRP3炎症小体刺激信号)诱导的线粒体碎裂、面积减少和网络结构破坏。作者检测ATP刺激后细胞的耗氧率,发现xanthone能够阻止细胞最大呼吸的下降。与之相符,xanthone能够在功能上上调线粒体膜电势,减少线粒体ROS的产生。这些数据表明xanthone能够在NLRP3激活后恢复巨噬细胞线粒体的健康。

为了探究xanthone如何重塑线粒体,作者使用4D蛋白质组学和非靶向代谢组学联合分析,发现xanthone能够导致葡萄糖代谢变化——从糖酵解往柠檬酸循环转移。进一步将得到的数据与MitoCartaDB线粒体蛋白质数据库联合分析,得到xanthone上调了线粒体结构相关基因,而control组细胞则更多地富集了线粒体翻译相关基因。
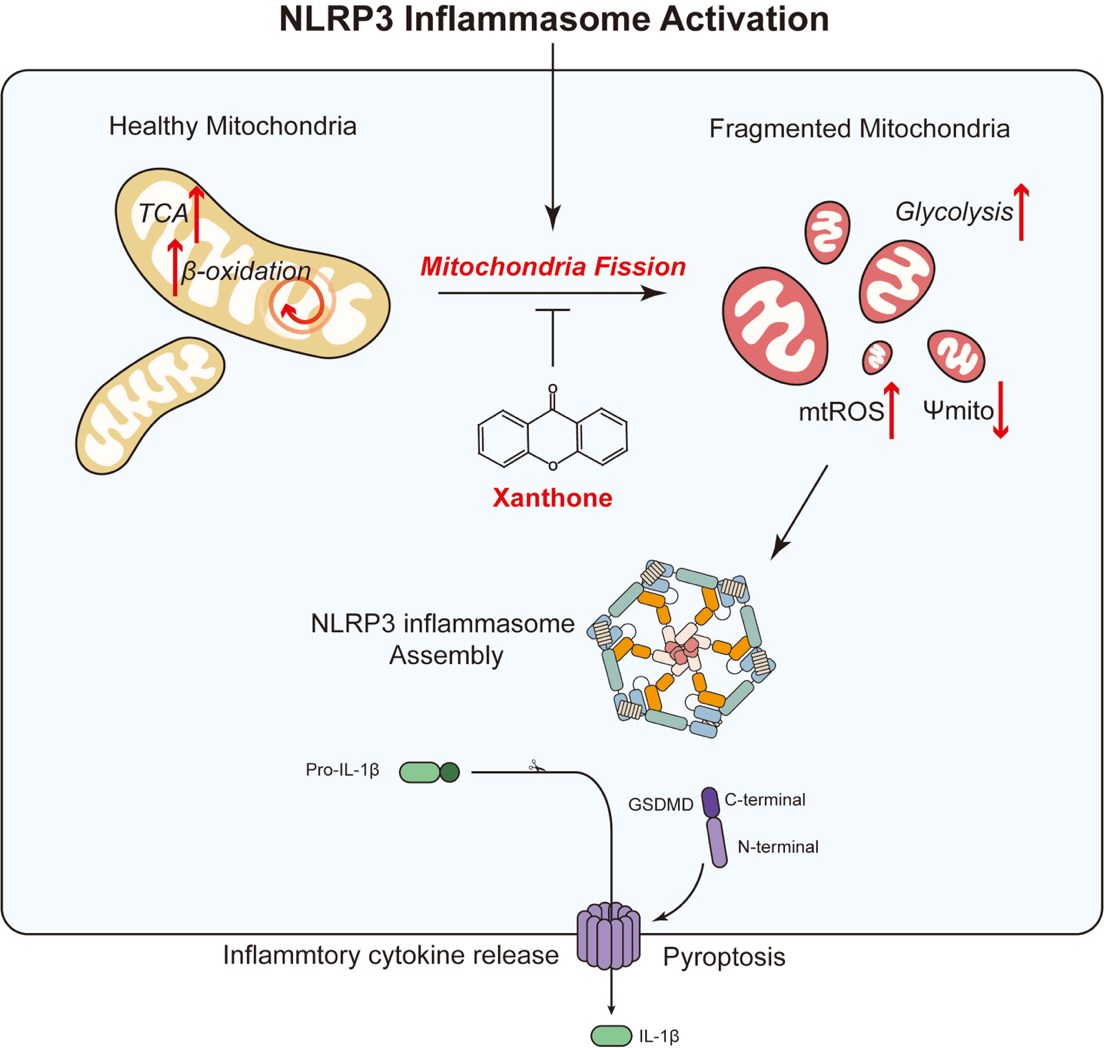
本研究通过筛选得到一种天然小分子化合物xanthone,其能通过NLRP3-IL-1β轴在小鼠角膜炎模型中发挥抗炎作用。机制探究发现xanthone通过代谢重塑巨噬细胞,恢复其线粒体健康,从而抑制NLRP3炎症小体的活化。文章提示xanthone可能作为潜在的小分子抑制剂药物来治疗角膜炎等NLRP3炎症小体过度活化的疾病。
浙江大学医学院附属第二医院眼科中心姚克教授为本文通讯作者,浙二眼科中心博士研究生崔文羽和浙二大肠外科博士研究生陈晟为论文共同第一作者,浙二眼科中心博士生导师韩海杰为本课题提供了重大帮助。该研究得到了国家自然科学基金和浙江省重点研发专项项目资助。
参考文献:
[1] Cui W, Chen S, Chi Z, Guo X, Zhang X, Zhong Y, Han H, Yao K. Screening based identification of xanthone as a novel NLRP3 inflammasome inhibitor via metabolic reprogramming. Clin Transl Med. July 2021;7(11):e496. doi: 10.1002/ctm2.496.
[2] Zhu S, Xu X, Wang L, Su L, Gu Q, Wei F, Liu K. Inhibitory effect of a novel peptide, H-RN, on keratitis induced by LPS or poly(I:C) in vitro and in vivo via suppressing NF-κB and MAPK activation. J Transl Med. Jan 2017;15(1):20. doi: 10.1186/s12967-017-1121-z.
[3] Swanson KV, Deng M, Ting JP. The NLRP3 inflammasome: molecular activation and regulation to therapeutics. Nat Rev Immunol. Aug 2019;19(8):477-489. doi:10.1038/s41577-019-0165-0.