
创新
近日,浙江大学附属二院眼科中心双聘研究员周民团队和姚克教授团队在材料领域顶级期刊《Advanced Materials》(中科院1区,IF: 32.086)发表题为“Visualized Gallium/Lyticase-Integrated Antifungal Strategy for Fungal Keratitis Treatment”的原创研究论文。周民研究员和姚克教授为论文的共同通讯作者。浙江大学转化医学研究院博士生何健为该文第一作者,浙大二院眼科中心博士生叶洋和转化院博士生张东晓为本文的共同第一作者。该研究报道了一种可视化镓/溶壁酶整合策略,通过共递送破坏细胞壁和生物膜的胞外多糖协同Ga离子杀灭真菌,用于真菌性角膜炎治疗 (示意图 1)。
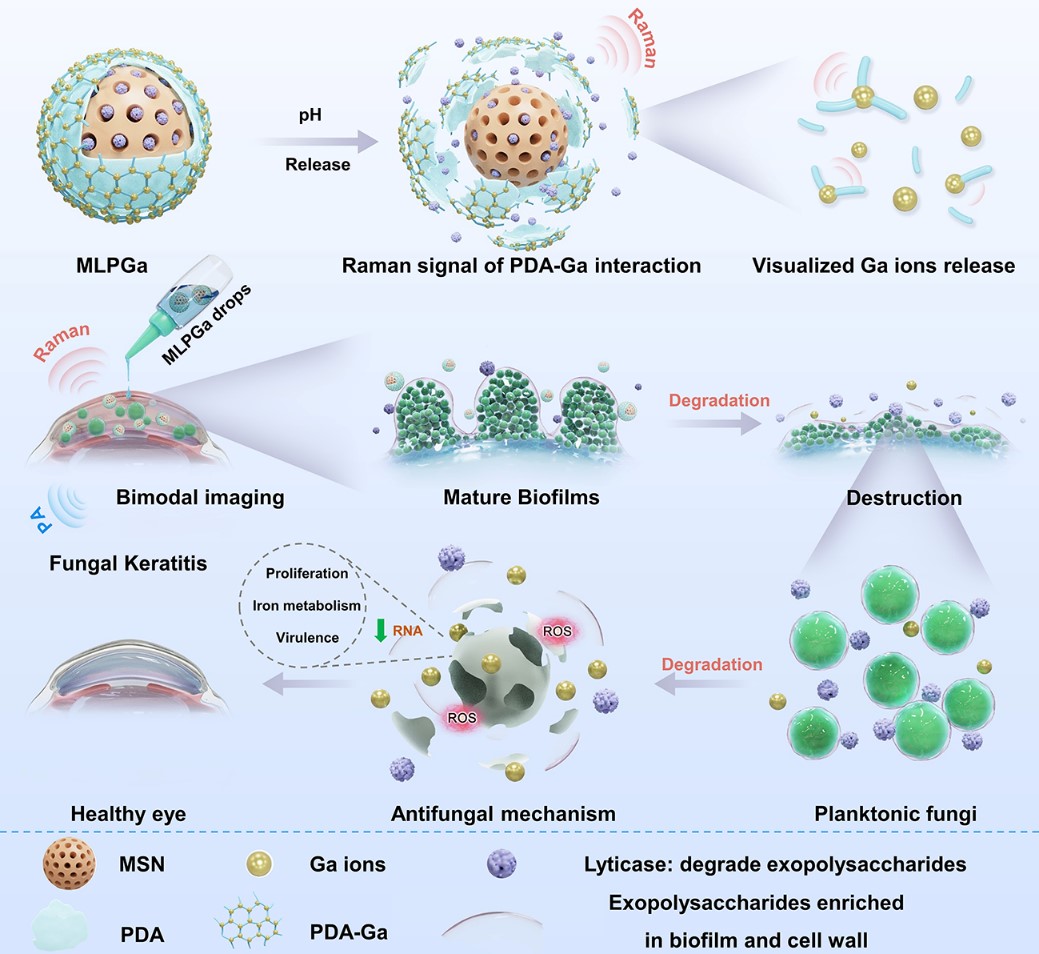
示意图1: 可视化镓/溶壁酶整合策略治疗真菌性角膜炎
01

研究背景

真菌性角膜炎是发展中国家最常见的致盲性眼病之一,随着临床上广谱抗菌素、糖皮质激素等药物的广泛使用,真菌性角膜炎的发病率逐渐升高,病情也更加严重。真菌感染起病缓慢、病程长,角膜结构和功能受真菌菌丝侵袭,角膜穿孔率高达30%以上。其治疗早期主要依赖如纳他霉素、两性霉素B等局部抗真菌药,但临床缺乏广谱高效的抗真菌药物,且存在眼用剂型的生物利用度低、耐药菌增多、需要多次频繁用药依从性差等缺陷,治疗效果有限。此外,相关研究发现,真菌细胞壁的胞外多糖,例如β-葡聚糖等对抗真菌剂的耐药性起到重要作用。特别是感染过程中,逐渐形成的真菌生物膜中的胞外多糖,会进一步产生渗透壁垒的作用,螯合抗真菌药物,防止其到达作用靶点。因此,针对真菌细胞壁与真菌生物膜共有的胞外多糖这个靶点开发新型的抗真菌药物一直是学科领域研究重点。
02

研究结果

该整合策略抗菌剂首先利用超声震荡的方法快速高效的将具有内切葡聚糖酶和蛋白酶活性的溶壁酶负载到多孔硅纳米载体上,之后利用多巴胺的附着能力,将镓离子(Ga)螯合并组装在多孔硅载体的表面,形成最终的溶壁酶/镓整合抗菌剂(MLPGa)。如图1所示,在丰富孔道的纳米多孔硅上可以看到明显的Ga元素信号。同时,负载螯合Ga离子之后,产生了多个强烈的拉曼光谱峰,为之后可视化的监测Ga离子的释放行为提供了便捷的途径。此后,本研究以白色念珠菌为研究对象,系统研究了MLPGa抗菌剂对其杀菌效果和杀菌机理。实验结果显示,该策略可以有效的降解白色念珠菌细胞壁和生物膜基质中的β-葡聚糖等胞外多糖,从而进一步提高Ga离子的杀菌作用,可以有效的去除游离的白色念珠菌和成熟的真菌生物膜(图2)。相关机理分析发现,MLPGa的潜在抗真菌的途径涉及活性氧的产生、干扰包括抗氧化,胞外多糖相关,铁离子利用,真菌生长发育以及毒力因子等基因和代谢过程。
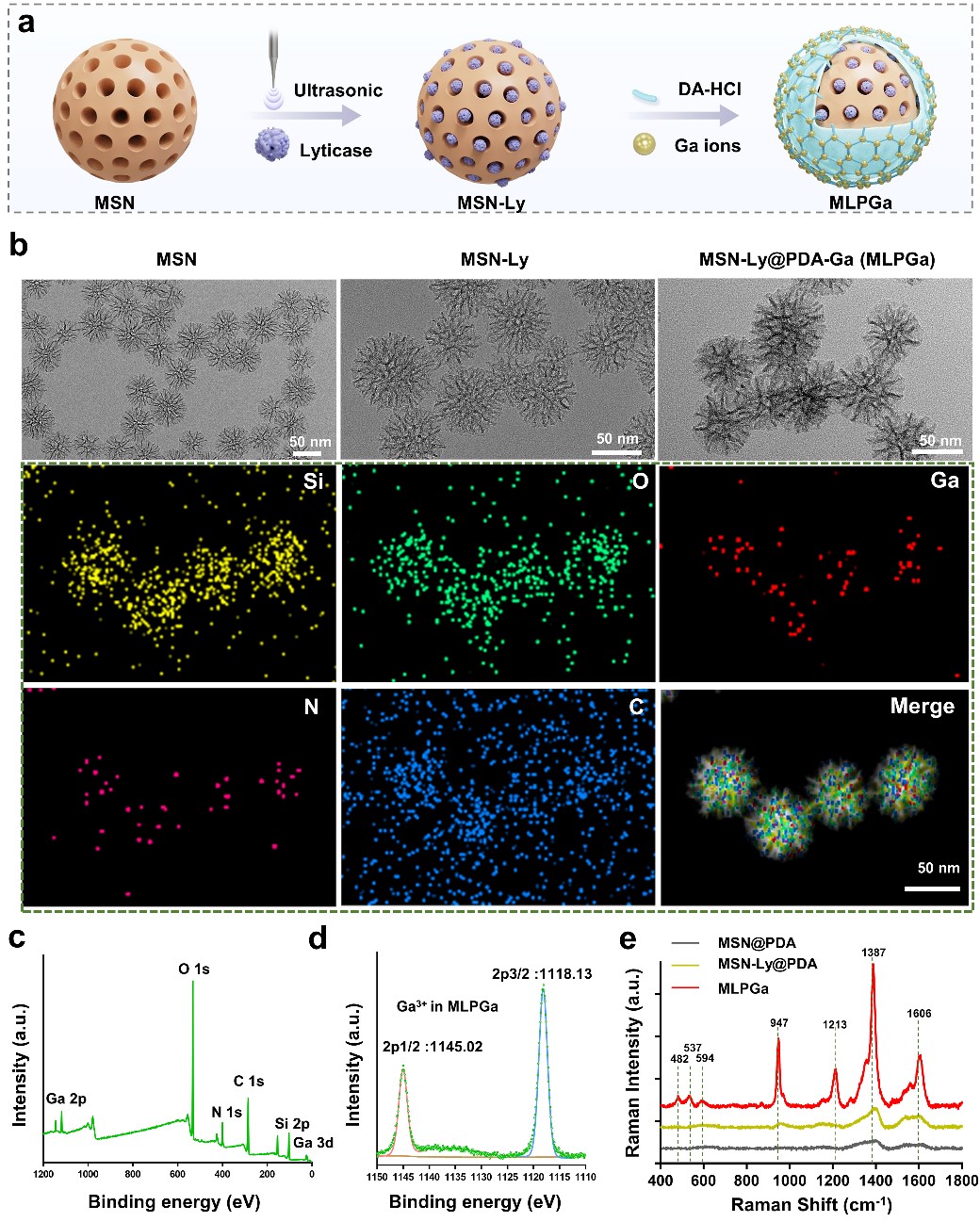
图1: 镓/溶壁酶整合抗菌剂设计
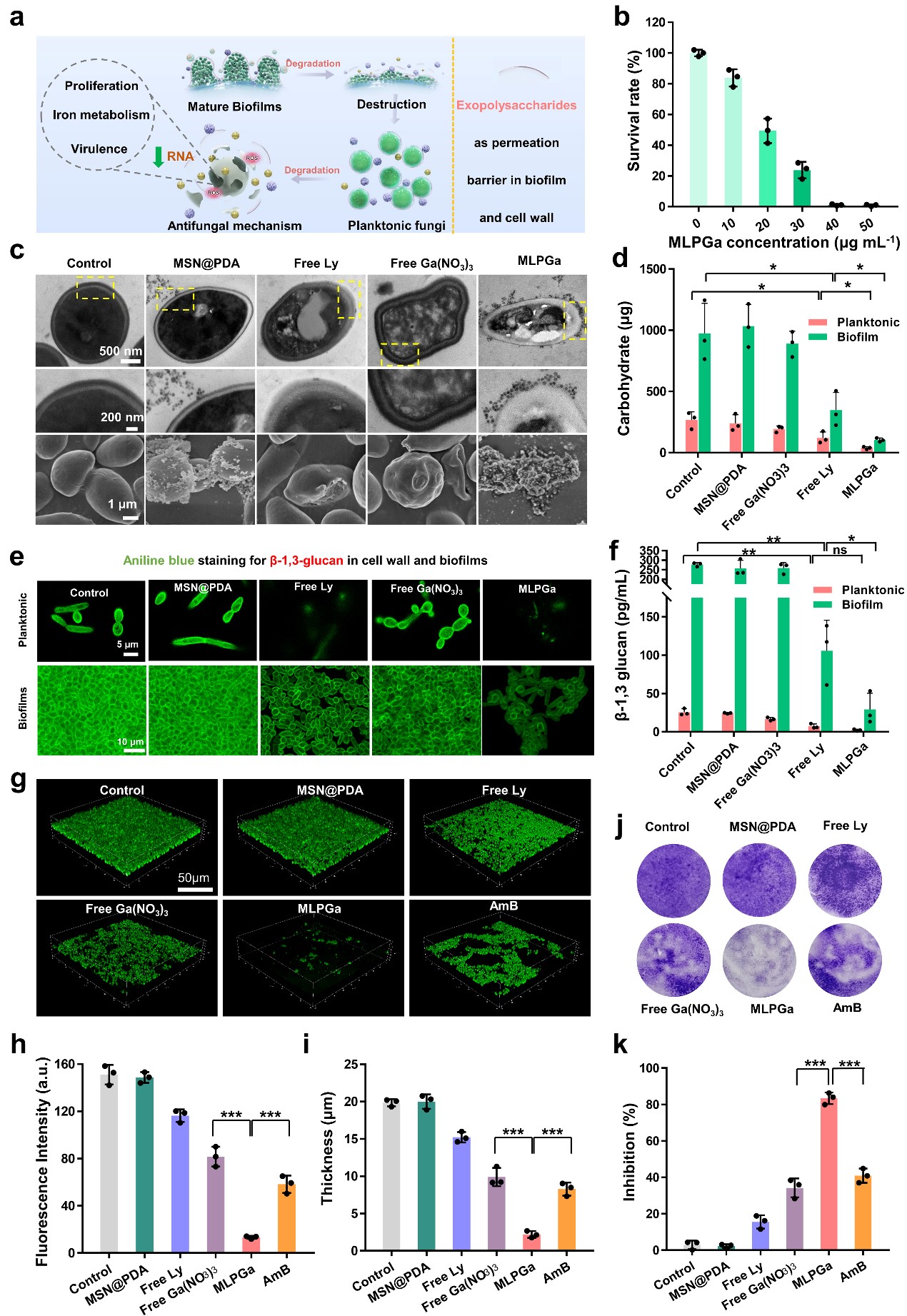
图2: 镓/溶壁酶整合抗菌剂降解胞外多糖和抗生物膜作用
在体外验证的基础上,同时以MLPGa纳米抗菌眼药水的形式,在小鼠真菌性角膜炎模型中进行验证。如图3所示,利用MLPGa中多巴胺本身的光声以及Ga螯合的拉曼进行双模态影像监控,表明MLPGa可以在感染眼部有效滞留和持续释放。在同等的给药条件下,MLPGa取得了比临床抗真菌剂两性霉素B更佳的治疗效果。15天时角膜恢复透明,上皮缺损愈合,感染被有效控制,治疗期间眼压保持稳定,病理及组织学分析发现治疗后真菌被有效杀灭,组织炎症细胞和炎症因子大量减少。不仅治疗效果优异,MLPGa还表现出较好的生物相容性,并未产生明显的全身以及眼局部的毒性,具有可观的转化前景来治疗目前临床上难治性的真菌性角膜炎问题。
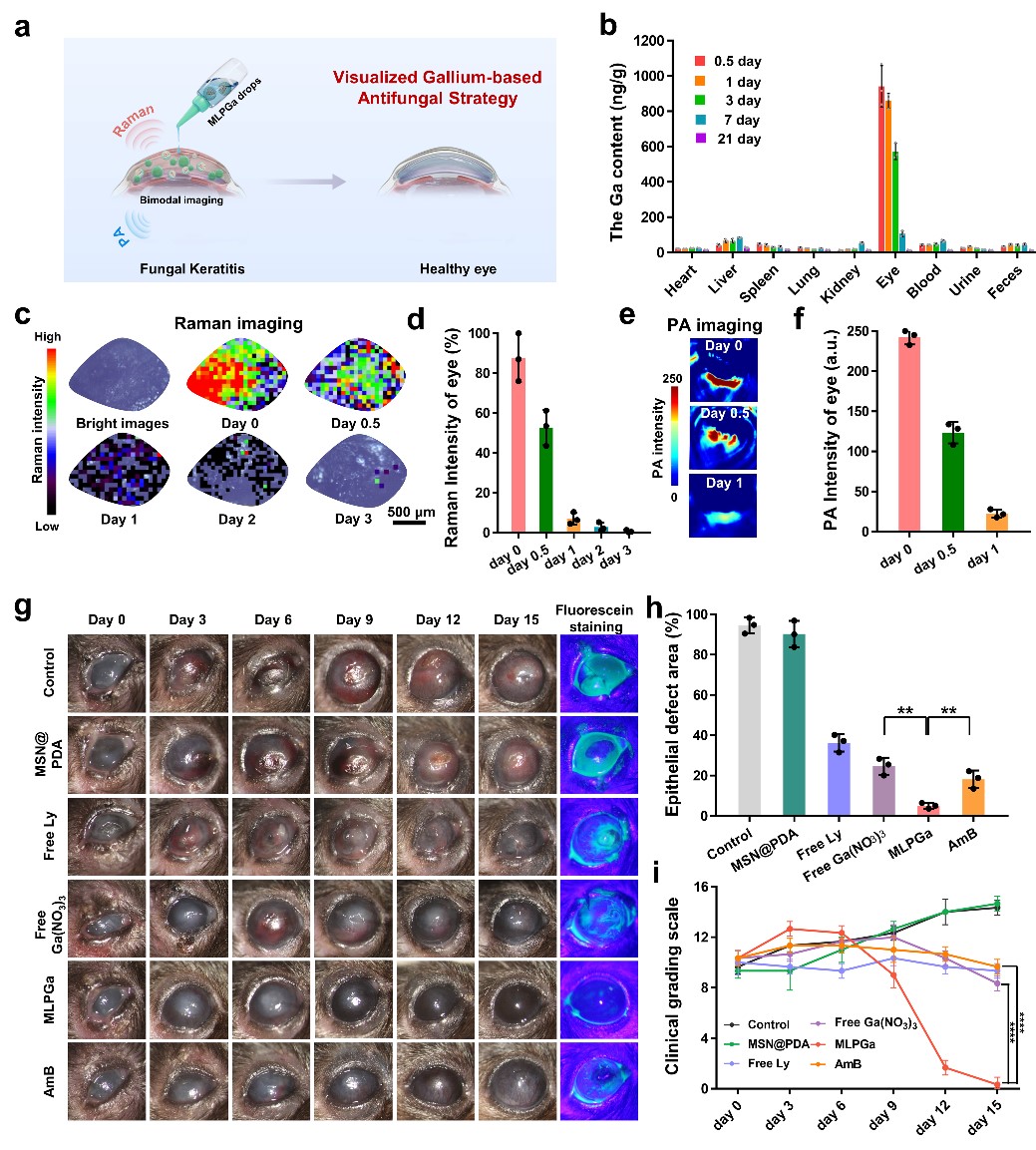
图3: 可视化镓/溶壁酶整合抗菌剂影像监控和真菌性角膜炎治疗
论文链接:https://doi.org/10.1002/adma.202206437.
总结
近年来,浙江大学转化院研究员周明团队联合浙大二院眼科中心姚克教授团队,以临床难治性感染性疾病问题为导向,深入开展生物材料的抗感染应用与基础研究。尤其是针对眼部感染疾病,前期研究的铜源纳米眼用凝胶项目,已经顺利开展临床试验,对感染性角膜炎取得了较好的治疗效果。同时也发表了一系列相关研究论文供参考(Nano Today 2021;ACS Nano 2021; Bioactive materials 2021; ACS Applied Bio materials 2021;ACS Nano 2020; Biomaterials 2020; Theranostics 2020;ACS Applied Materials & Interfaces 2019; ACS Applied Materials & Interfaces 2018 )。