
近十年来,随着中国社会经济的不断发展与环保意识的持续提高,雾霾污染问题引发广泛关注,粒径≤2.5μm的细颗粒物(PM2.5)作为雾霾的主要成分,其对于人体健康的不利影响已非常明确。一是PM2.5短期内增加对心脑血管意外、哮喘等疾病有直接关联,二是PM2.5长期高水平对于肺癌、慢阻肺、动脉粥样硬化,乃至于总死亡率的升高均有明确关系。对于PM2.5急性与持续性升高下致病机制具有共性又存在差异的普遍特征,团队以短期与长期暴露的双重视角,近年来系统性探索了PM2.5对角膜、晶状体、脉络膜、视网膜等各眼球亚结构的作用。
其中,针对雾霾对角膜缘干细胞微环境影响的病理机制研究“Long-term PM2.5 exposure disrupts corneal epithelial homeostasis by impairing limbal stem/progenitor cells in humans and rat models”于今年7月率先发表。今年12月,研究论文“Acute and continuous exposure of airborne fine particulate matter (PM2.5): diverse outer blood-retinal barrier damages and disease susceptibilities”紧随其后发表,描述了雾霾对眼底脉络膜和视网膜色素上皮的不良影响。这是团队围绕大气污染相关性眼病连续发表七篇重磅系列论文之后,继续深入探索取得的延续性成果。

“PM2.5急性和持续暴露下外血视网膜屏障不同的损伤和疾病潜在关联”(2023)

“PM2.5长期暴露通过损伤角膜缘干/前体细胞破坏角膜上皮稳态”(2023)
由于视网膜位于眼球内部,并不与外界空气直接接触,因此空气污染对视网膜的损伤作用长期以来往往受到忽视。那么眼底病是否与雾霾有联系呢?就像PM2.5会进入血液循环引起心血管系统的损害类似,眼底因其具备脉络膜和视网膜血管丰富血液供应的特点,同样易受PM2.5的影响。目前已有来自各国的多项临床研究在人群水平明确了PM2.5高暴露与年龄相关性黄斑变性(AMD)、视网膜中央动脉阻塞(CRAO)等疾病存在关联,并与视网膜血管管径和视网膜各层厚度的变化相关。为了弥补PM2.5诱发视网膜疾病致病机制研究上的空白,团队于2022年6月在环境科学权威期刊Science of the Total Environment(IF:9.8)发文,提出PM2.5短期暴露将通过引起视网膜血管内皮的氧化应激与铁死亡,导致内血视网膜屏障(iBRB)的通透性升高,从而增大视网膜水肿、渗出的风险。
“PM2.5暴露对内血视网膜屏障的损伤及机制研究”(2022)
视网膜结构和功能稳态的维持除了有赖于完整的iBRB之外,外血视网膜屏障(oBRB)同样至关重要。oBRB由关系紧密的视网膜色素上皮(RPE)和脉络膜血管网组成,其屏障功能的损失往往是AMD等不可逆性致盲性眼病的共性病理因素,团队为进一步探究PM2.5对oBRB的影响,以及更广泛的眼底疾病潜在关联,在Particle and Fibre Toxicology发表题为“Acute and continuous exposure of airborne fine particulate matter (PM2.5): diverse outer blood-retinal barrier damages and disease susceptibilities”的研究论文。作者首先在PM2.5短期暴露的小鼠中观察到了部分区域RPE单层细胞完整性及细胞间紧密连接的破坏,以及RPE上方视网膜水肿的出现。并检测到脉络膜血管的局部扩张、脉络膜增厚与炎症水平升高,这些病理改变及病程特征均与以中心性浆液性脉络膜视网膜病变(CSC)为代表的厚脉络膜谱系疾病十分相似。而在小鼠接受PM2.5长期暴露后,短期暴露时RPE缺损区域及紧密连接得到一定程度的不规则修复,视网膜水肿消失,但脉络膜依旧处于炎症上调状态,并借助OCTA和扫描电镜检测到了视网膜新生血管的出现以及Bruch’s膜增厚等AMD早期特征性病理改变。为了探究PM2.5短期和长期暴露下脉络膜血管网与RPE的相互作用,作者创新性地聚焦脉络膜血管扩张这一中枢性病理特征,构建了拉伸的血管内皮细胞与ARPE-19细胞共培养模型,在短期与长期共培养下均发现了与小鼠RPE相似的表现。
总而言之,该项研究首次在动物模型上围绕PM2.5不同暴露时长下oBRB的多种表型做了系统描述,从病理学角度提示了雾霾与AMD、CSC等高发眼底疾病发生发展的关联性,并印证了脉络膜血管扩张是其中关键性的中枢环节,为雾霾相关眼底病的早期干预提供了潜在切入点。
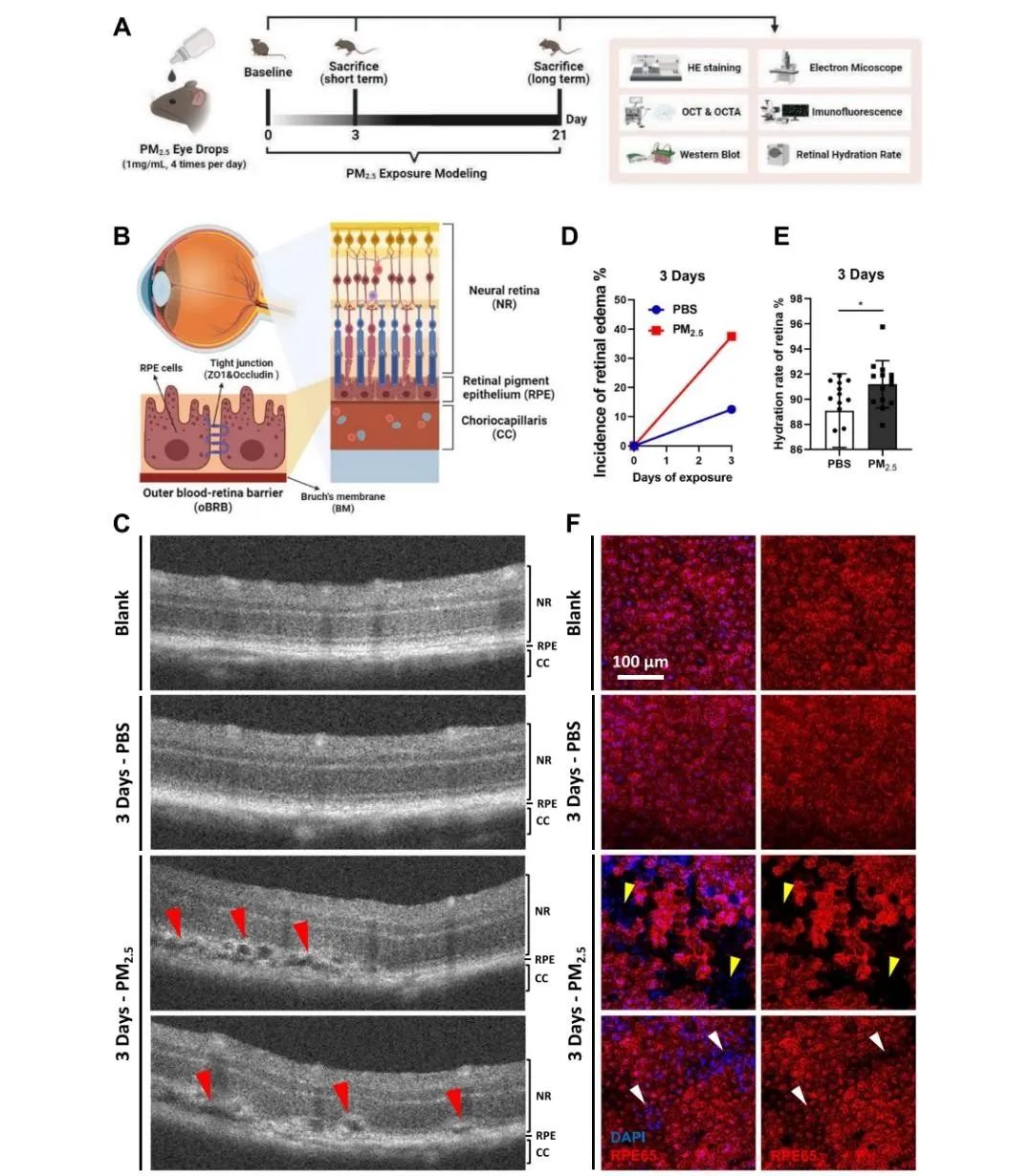
图:PM2.5短期暴露下小鼠RPE完整性受损引发视网膜水肿
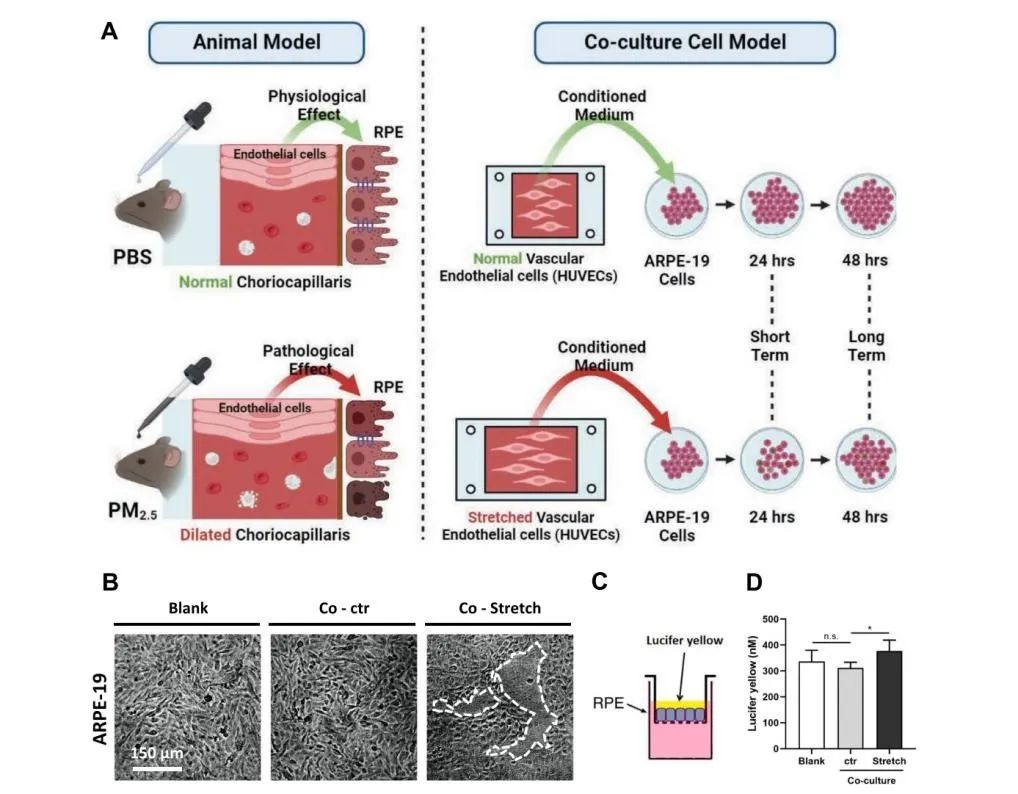
图:构建拉伸的血管内皮细胞与ARPE-19细胞共培养模型
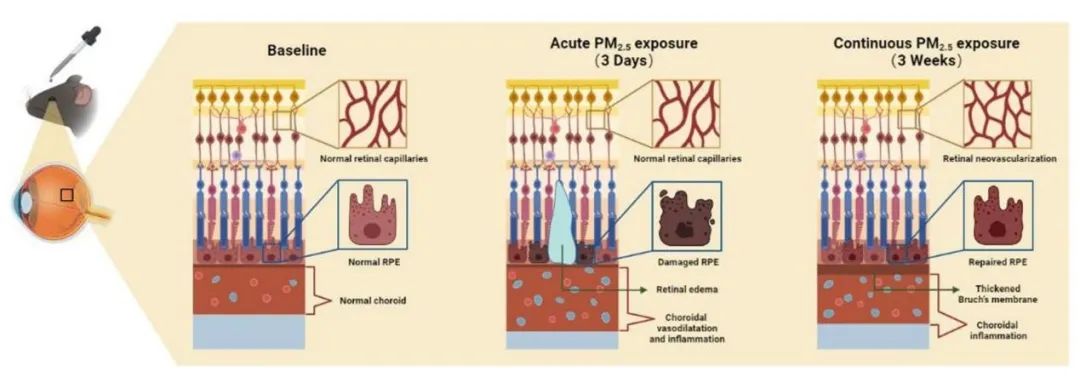
图:PM2.5短期和长期暴露下RPE与脉络膜血管网的不同变化
角膜由于位于眼表直接与外界接触,极易受到空气污染物的损伤。角膜上皮是角膜抵抗外界刺激的第一道屏障,其更新与修复均来源于位于角巩膜交界处的角膜缘干/前体细胞(LSPCs),LSPCs位于由血管、神经、基质细胞、黑色素细胞、免疫细胞等共同组成的干细胞龛内,其干性受各组分共同调节,LSPCs的损伤则会导致角膜上皮修复能力的严重抑制,影响角膜透明度甚至引起失明。
为了探明PM2.5暴露对于LSPCs有何影响,作者在Particle and Fibre Toxicology发表题为“Long-term PM2.5 exposure disrupts corneal epithelial homeostasis by impairing limbal stem/progenitor cells in humans and rat models”的研究论文,首先着眼于人群层面,通过自2018年至2022年就诊于浙二眼科中心患者的眼前节OCT检查数据,发现生活在PM2.5较高浓度地区的人群角膜缘上皮层更薄,表明PM2.5引发了LSPCs的损失。进一步在大鼠模型中,长期暴露于PM2.5也导致了类似现象,以及LSPCs增殖和分化能力的减退。然而,在短期暴露的大鼠模型中,LSPCs的增殖和向角膜上皮分化的潜能被暂时激活。为深入探究其中机制,PM2.5短期暴露下大鼠角膜缘上皮组织的转录组测序表明,PM2.5影响下LSPCs的昼夜节律受到干扰。包括Per1、Per2、Per3和Rev - erbα在内的昼夜节律基因表达在PM2.5短期和长期暴露模型中均显著上调,表明昼夜节律参与了LSPCs的干性激活和抑制。最后,作者在大鼠模型上进一步探究了PM2.5对角膜缘微环境的影响,主要表现为角膜基质下神经纤维密度、血管密度和血管通透性以及免疫细胞浸润的变化,这些异常表现进一步加剧了LSPCs的昼夜节律失调和增殖分化功能障碍。
综上所述,本项研究从角膜缘微环境稳态维持的全新视角,发现长期暴露于PM2.5会导致LSPCs功能紊乱和角膜上皮失代偿,最终导致多种角膜疾病。并创新性提出昼夜节律紊乱与LSPCs的激活和失调有关,提示针对昼夜节律的治疗可能会成为减轻雾霾相关角膜损伤的潜在手段。
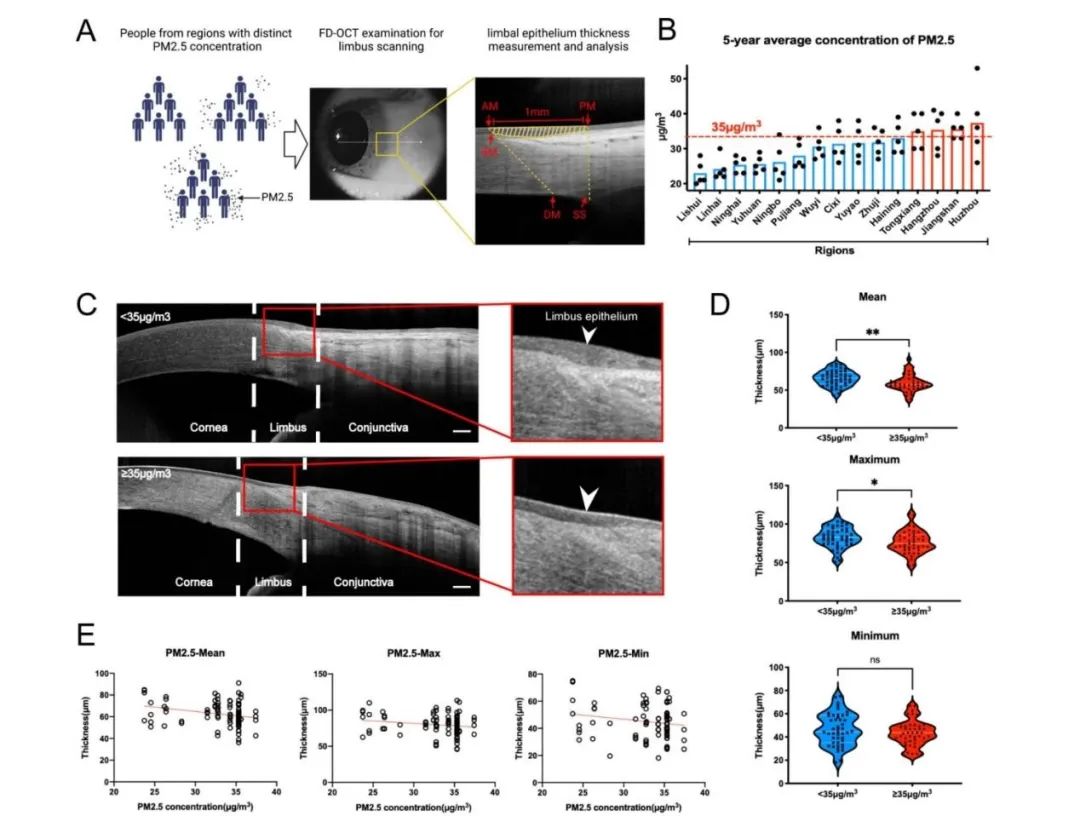
图:PM2.5暴露与人类角膜缘上皮厚度的关系
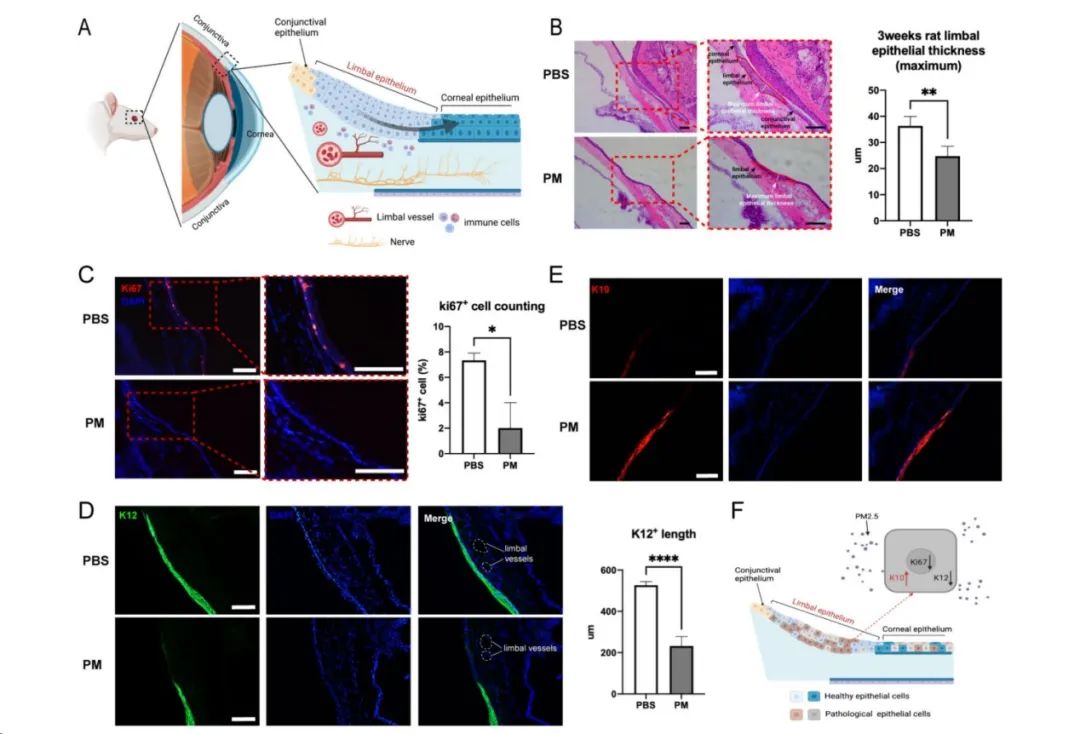
图:长期慢性暴露于PM2.5将损害LSPCs的增殖和分化能力
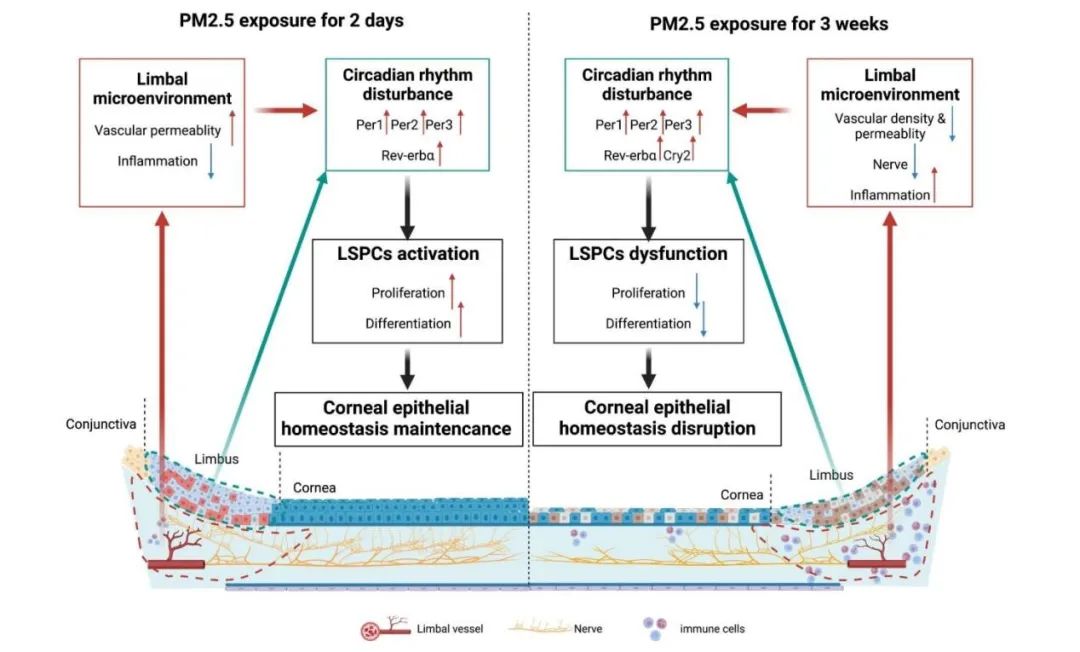
图:PM2.5短期和长期暴露下LSPCs昼夜节律和干细胞微环境的不同变化
今后,浙二眼科中心还将在前期研究基础上继续深入探索雾霾相关性角膜病和眼底病的病理机制和治疗靶点,筛选临床药物,并进一步探索PM2.5与其他眼科疾病的潜在关联,以期为社会公共卫生政策的制定提供科学依据,为广大患者提供疾病预防和治疗的有效策略。
原文链接:
https://doi.org/10.1186/s12989-023-00540-y
https://doi.org/10.1186/s12989-023-00558-2
团队围绕大气污染与眼健康系列论文:
1) Fu Q, Mo Z, Lyu D, et al. Air pollution and outpatient visits for conjunctivitis: A case-crossover study in Hangzhou, China. Environ Pollut. 2017;231(Pt 2):1344-1350.
2) Fu Q, Lyu D, Zhang L, et al. Airborne particulate matter (PM2.5) triggers autophagy in human corneal epithelial cell line. Environ Pollut. 2017;227:314-322.
3) Mo Z, Fu Q, Lyu D, et al. Impacts of air pollution on dry eye disease among residents in Hangzhou, China: A case-crossover study. Environ Pollut. 2019;246:183-189.
4) Lyu D, Chen Z, Almansoob S, et al. Transcriptomic profiling of human corneal epithelial cells exposed to airborne fine particulate matter (PM2.5). Ocul Surf. 2020;18(4):554-564.
5) Fu Q, Mo Z, Gu Y, et al. Association between outpatient visits for pterygium and air pollution in Hangzhou, China. Environ Pollut. 2021;291:118246.
6) Song F, Chen Z, Lyu D, et al. Expression profiles of long noncoding RNAs in human corneal epithelial cells exposed to fine particulate matter. Chemosphere. 2022;287(Pt 1):131955.
7) Gu Y, Hao S, Liu K, et al. Airborne fine particulate matter (PM2.5) damages the inner blood-retinal barrier by inducing inflammation and ferroptosis in retinal vascular endothelial cells. Sci Total Environ. 2022;838(Pt 4):156563.
8) Hao S, Chen Z, Gu Y, et al. Long-term PM2.5 exposure disrupts corneal epithelial homeostasis by impairing limbal stem/progenitor cells in humans and rat models. Part Fibre Toxicol. 2023;20(1):36. Published 2023 Sep 27.
9) Gu Y, Sheng F, Gao M, et al. Acute and continuous exposure of airborne fine particulate matter (PM2.5): diverse outer blood-retinal barrier damages and disease susceptibilities. Part Fibre Toxicol. 2023;20(1):50. Published 2023 Dec 18.

通讯作者:姚克 教授
主任医师,博士生导师

通讯作者:傅秋黎 副研究员
博士,硕士生导师

第一作者:郝圣杰
浙江大学医学院,博士研究生
浙江大学医学院眼科学直博生,师从姚克教授,主要研究方向为环境污染与眼表疾病相关性及机制探索、生物力学在眼部疾病及眼发育中的作用研究,以第一/共同第一作者发表SCI论文数篇。

第一作者:顾宇舟
浙江大学医学院,博士研究生
浙江大学医学院眼科学博士研究生,师从姚克教授和傅秋黎副研究员,主要研究方向为环境污染相关视网膜疾病的机制探索、以再生晶状体为模型探究白内障致病机制和新治疗手段,以第一/共同第一作者发表SCI论文数篇。