

近日,浙大二院眼科中心双聘教授、浙江大学良渚实验室孔娜研究员,浙大二院眼科中心姚克教授与哈佛医学院布莱根妇女医院陶伟教授在Cell Press细胞出版社期刊Trends in Biotechnology(IF:17.3)发表了题为“Ocular RNA nanomedicine: engineered delivery nanoplatforms in treating eye diseases”的综述。该论文系统总结了近年来RNA纳米药物在眼部疾病治疗的最新进展,重点探讨了RNA递送策略的发展脉络、临床进展以及眼部疾病治疗的现存挑战。

眼部疾病仍然是全球重大的健康挑战,许多患者的医疗需求尚未得到满足。RNA纳米药物因其在治疗基因相关眼病中的显著疗效和安全性,已经受到越来越多的关注。然而,由于RNA的不稳定性、靶向效应以及眼部生理屏障,RNA在眼部疾病治疗中的有效递送面临巨大挑战。特定设计的RNA药物结合精心设计的递送平台,能够有效克服眼部疾病治疗中的诸多障碍。具体而言,这些递送平台能够保护RNA免受降解,增强其在靶组织中的稳定性和递送效率。例如,开发的脂质纳米颗粒(LNPs)能够成功递送治疗性mRNA到视网膜色素上皮细胞和Müller胶质细胞,显著改善了视网膜疾病的治疗效果。
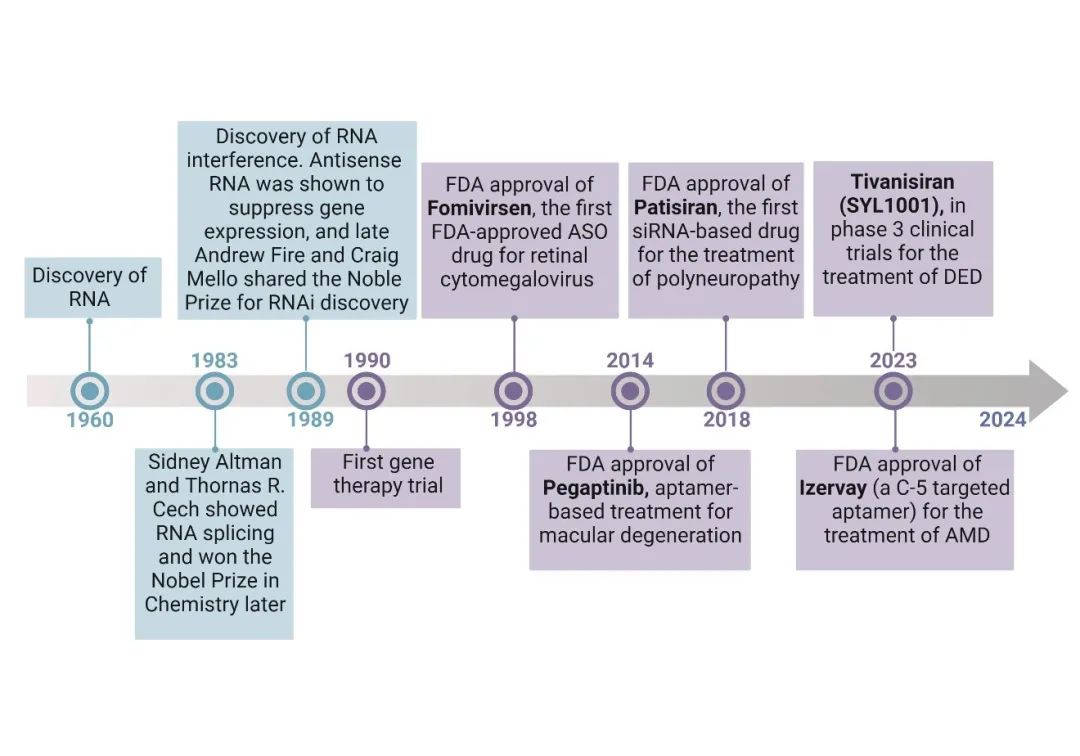
图1 . RNA纳米药物用于眼部疾病治疗的发展
RNA纳米药物包括多种类型,如适体、微小RNA(miRNA)、小干扰RNA(siRNA)、反义寡核苷酸(ASO)、信使RNA(mRNA)和环状RNA(circRNA),它们共同提供了多样的策略来抑制或过表达某些眼病相关的特定基因。Iveric Bio的Izervay是一种适体治疗药物,靶向并抑制补体成分5,已被FDA批准用于治疗年龄相关性黄斑变性(AMD)的地理性萎缩和Stargardt病。QR-504a是一种反义寡核苷酸治疗药物,在临床前表现出良好的效果,但其临床试验发展仍面临考验。另外多种RNA纳米药物目前正在进行临床试验,并且显示出改善眼科疾病治疗效果的巨大潜力。RNA靶向治疗提供了一种有别于传统基因组治疗的新方法,允许进行特定的、可逆的基因修饰,而不会对宿主的DNA造成永久性改变。未来,这一研究有望推动RNA纳米药物在其他复杂疾病中的应用,并为精准医疗的发展提供重要支持。
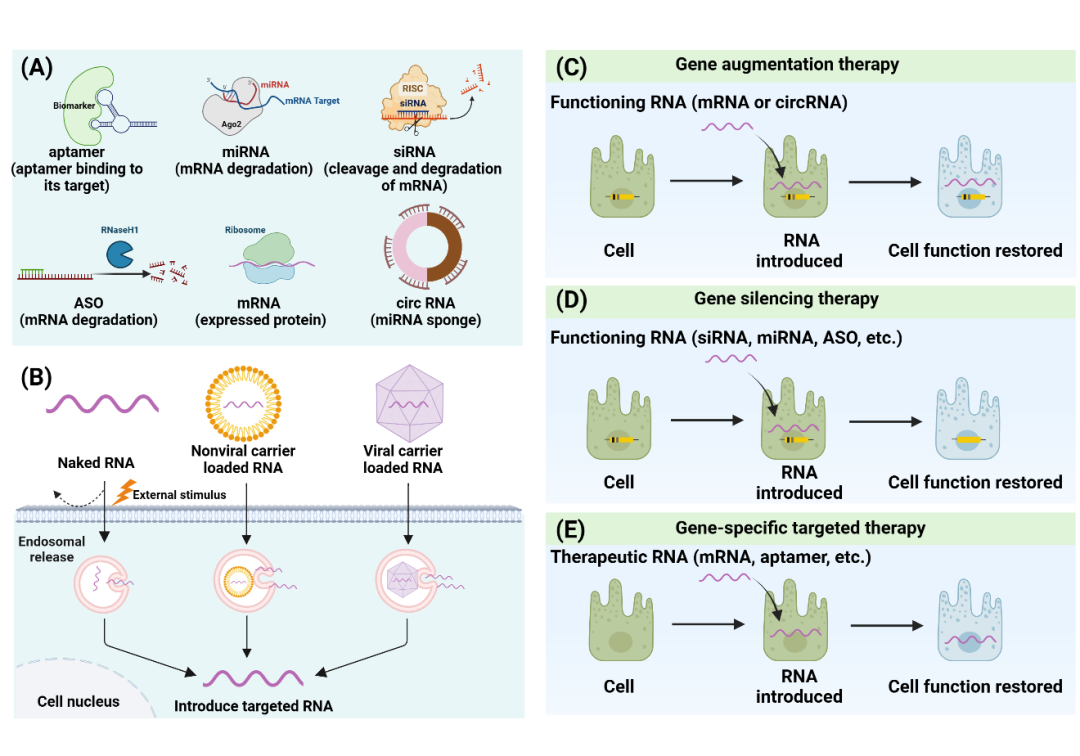
图2. 不同种类RNA疗法的作用模式
RNA药物的设计和优化使其能够更有效地穿透眼部屏障,并在靶细胞中发挥作用。例如,化学修饰的RNA分子不仅增强了其稳定性和降低了免疫原性,还保护了其脆弱的糖-磷酸骨架,减少了脱靶效应。此外,将RNA封装在纳米材料中进一步提高了其生物相容性和降低了免疫原性。这些优化措施显著提升了RNA药物在治疗中的效果。递送RNA到眼部的内部挑战在于眼睛的独特解剖结构和生理屏障,这些屏障限制了药物在目标部位的浓度。例如,泪膜屏障和角膜屏障都显著降低了药物的生物利用度。为了克服这些挑战,研究团队开发了多种创新的纳米递送平台,包括脂质纳米颗粒(LNPs)、聚合物纳米颗粒、生物纳米载体等。
3.1
脂质纳米载体
脂质纳米颗粒(LNPs)作为一种非病毒平台,已经在临床上成功用于mRNA递送。LNPs具有配方简单、生物相容性好、生产成本低等优点,使其成为临床眼科治疗中极具前景的药物递送载体。例如,研究团队开发的LNPs成功地将mRNA递送到视网膜色素上皮细胞和Müller胶质细胞,显著改善了视网膜疾病的治疗效果。
3.2
聚合物纳米载体
聚合物纳米载体是由天然或合成材料生成的纳米结构,具有高度可控的性质和表面修饰的简便性。例如,一项研究报告显示,PEG化的脂质-蛋白质-透明质酸纳米颗粒(PEG-LPH-NP-S)在小鼠模型中有效减少了脉络膜新生血管的面积。此外,设计成章鱼状结构的多价穿透素(MVP)使用聚乙二醇(PEG)核,能够高效递送治疗性siRNA,显示了在非侵入性眼内基因递送中的巨大潜力。
3.3
生物纳米载体
生物纳米载体,特别是外泌体,在RNA药物递送中展现出独特的优势。外泌体是一种由细胞释放的微小胞外囊泡,具有天然的生物相容性和低免疫原性,能够有效地穿越生物膜,将复杂的货物递送到目标细胞。例如,研究团队开发了一种基于间充质干细胞外泌体的眼药水(MSC-exo),装载miR-204,为干眼病的治疗提供了一种安全、非侵入性的治疗策略。该外泌体眼药水能够调节眼表面M1和M2巨噬细胞之间的平衡,通过miR-204/IL-6/STAT3轴显示了在Benzalkonium chloride (BAC) 诱导的小鼠模型和Graft-versus-host disease (GVHD) 相关干眼病中的有效治疗结果。
3.4
无机/有机混合纳米载体
无机/有机混合纳米载体显示出增强靶向递送和提供多功能性的潜力。研究团队开发了基于刺激响应的二氧化硅纳米粒子(SNP)系统,这些纳米粒子能够高效递送核酸(如DNA和mRNA)和CRISPR基因编辑器到小鼠视网膜色素上皮细胞和肝细胞,促进高效的基因组编辑。此外,抗体结合的PEI封盖金纳米颗粒加载siRNA分子,成功用于下调视网膜母细胞瘤(RB)细胞中的上皮细胞粘附分子(EpCAM)表达。这些混合纳米载体通过提供独特的电、磁和光学特性,进一步拓宽了RNA递送的范围。
3.5
新型纳米载体
病毒样颗粒(VLPs)是一种创新的药物递送平台,模仿病毒的外部结构,但没有病毒的基因组,因而没有感染性。VLPs结合了病毒载体和非病毒载体的优点,能够高效递送RNA药物。例如,研究团队利用病毒工程技术,开发了一种新的VLP递送技术,通过视网膜下注射递送CRISPR到视网膜色素上皮(RPE)细胞,在AMD模型中实现了高达44%的血管内皮生长因子A(VEGFA)基因敲除,并减少了63%的新生血管面积。进一步的发展包括基于VLP技术的单纯疱疹病毒(HSV-1)擦除慢病毒颗粒(HELP)递送系统,该系统克服了腺相关病毒(AAV)载体的载量限制和长期Cas9表达的安全风险。
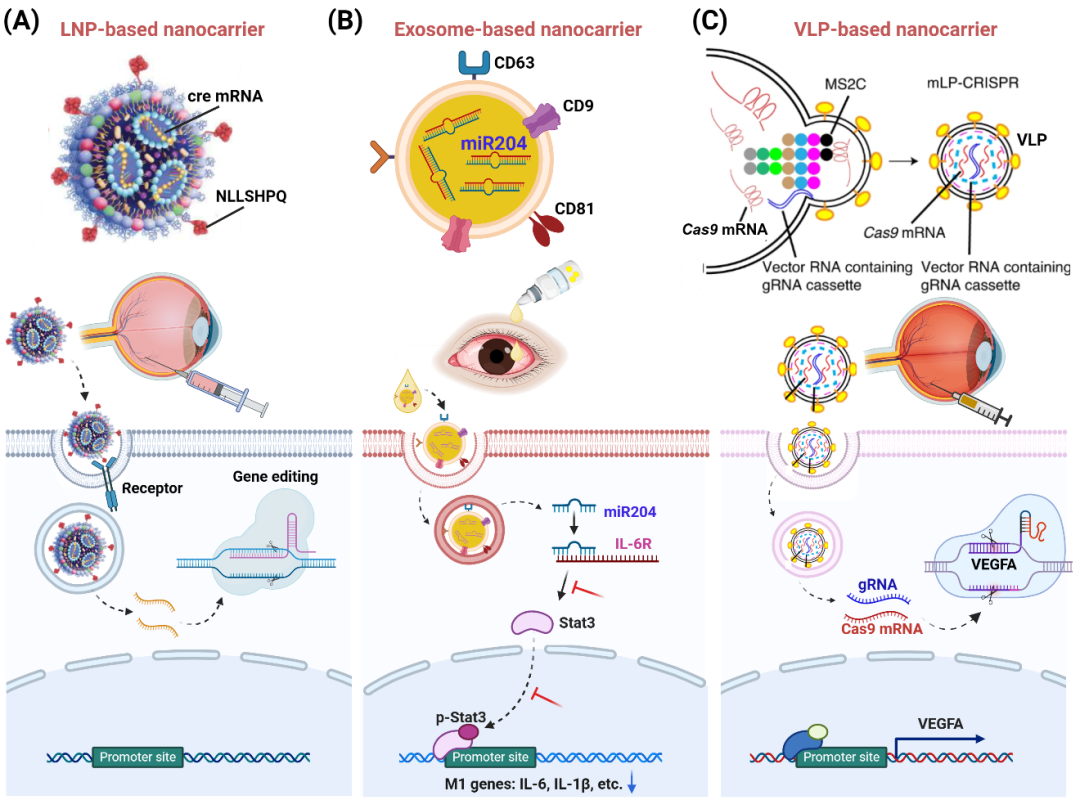
图3. RNA纳米药物载体设计与眼部疾病治疗
RNA纳米药物在眼科疾病治疗中的应用为精准医疗提供了新的可能性。通过持续的研究和创新,研究团队有望开发出更多安全、高效的RNA纳米药物,结合多样的核酸药物递送平台,为患者带来更多治疗选择。此外,RNA纳米药物在癌症、心血管疾病和神经系统疾病等领域也显示出巨大的潜力,未来有望成为治疗多种复杂疾病的重要工具。